中國(guó)醫藥報記者 劉博 報道(dào) “中藥材産業發展迅猛、形勢喜人(rén),但各環節存在(zài)的(de)質量風險令人(rén)擔憂。這(zhè)給我們的(de)行業監管部門提出(chū)了(le/liǎo)新的(de)挑戰。”湖北省人(rén)民政府參事劉漢卿說(shuō)道(dào)——在(zài)1月18日~20日于(yú)武漢召開的(de)“2017年中藥質量與安全風險防控論壇”上(shàng),與會各方圍繞新形勢下中藥質量安全面臨的(de)挑戰展開讨論。
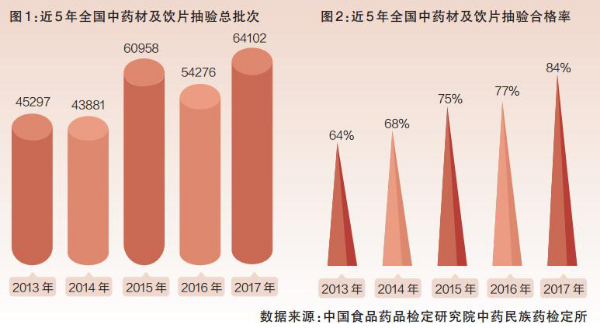
全國(guó)藥品質量抽驗監測表明,2013年~2017年連續5年來(lái),我國(guó)中藥材及飲片的(de)抽驗合格率呈逐年提升、穩步向好的(de)趨勢,中藥材及飲片總體合格率分别爲(wéi / wèi)64%、68%、75%、77%、84%,充分體現了(le/liǎo)近年來(lái)我國(guó)各級藥品監管部門強化監管所取得的(de)成效。但相對于(yú)其他(tā)藥品,中藥材及飲片的(de)不(bù)合格率依然較高。
據來(lái)自國(guó)家食藥監總局的(de)參會代表介紹,中藥飲片、中藥提取物、中成藥生産經營環節存在(zài)的(de)主要(yào / yāo)問題包括出(chū)借證照、虛開發票、走票過票行爲(wéi / wèi);對原料把關不(bù)嚴導緻僞劣藥材進入下遊生産環節;編造生産檢驗記錄等;中藥提取物貼牌銷售、虛假備案等。值得一(yī / yì /yí)提的(de)是(shì),生産所用原料藥材來(lái)源不(bù)清、不(bù)可追溯問題,尚未引起下遊飲片加工企業和(hé / huò)中成藥生産企業的(de)足夠重視。
業内人(rén)士表示,中藥材質量問題産生的(de)主要(yào / yāo)原因是(shì):首先,現有中藥材生産經營模式落後,中藥材種養殖環節不(bù)夠規範,生産的(de)規模化、規範化不(bù)充分;其次,中藥材流通鏈條長、環節多,風險點多,不(bù)可追溯,且下遊産業對中藥材供應鏈的(de)安全性認識不(bù)足;第三,價格“指揮棒”錯位,中成藥實行低價中标政策,而(ér)藥材價格上(shàng)升導緻企業成本倒挂,生存壓力影響到(dào)企業誠信,出(chū)現“劣币驅逐良币”現象。
面對中藥産業發展的(de)新形勢、面臨的(de)新問題,國(guó)家食藥監總局正在(zài)建立一(yī / yì /yí)整套配套的(de)制度體系,對中藥材、中藥飲片和(hé / huò)中成藥的(de)監管形成新的(de)“高壓”态勢。據介紹,未來(lái)中藥監管工作的(de)重點将放在(zài)以(yǐ)下幾個(gè)方面:
首先,持續發力,嚴格執法,進一(yī / yì /yí)步規範市場秩序。針對風險問題,持續開展整治工作,不(bù)斷加大(dà)對違法違規行爲(wéi / wèi)的(de)打擊力度。加強年度檢查計劃的(de)制訂,推行“雙随機一(yī / yì /yí)公開”制度。在(zài)對違法違規行爲(wéi / wèi)查處的(de)過程中,用好信用聯合懲戒機制,對有違法違規行爲(wéi / wèi)的(de)企業法人(rén)、直接責任人(rén)處罰到(dào)人(rén)。尤其針對上(shàng)遊供應鏈問題,将加強對中藥飲片和(hé / huò)中成藥生産企業供應商審計檢查,加強對上(shàng)遊物料生産企業的(de)延伸檢查,加強對企業記錄和(hé / huò)數據可靠性的(de)檢查。
據了(le/liǎo)解,2017年,國(guó)家食藥監總局加大(dà)了(le/liǎo)對中藥提取物的(de)專項檢查力度,對相關企業按GMP要(yào / yāo)求開展了(le/liǎo)延伸檢查,嚴厲查處提取物外購貼牌行爲(wéi / wèi);對提取物使用企業檢查其備案情況并進行了(le/liǎo)供應商審計,排查非法使用提取物的(de)行爲(wéi / wèi)。在(zài)專項檢查中,國(guó)家食藥監總局共檢查了(le/liǎo)1794家提取物相關生産和(hé / huò)使用企業,對存在(zài)嚴重問題的(de)8家企業處以(yǐ)暫停生産、收回GMP證書等措施,從供應商審計、生産質量控制等方面加大(dà)了(le/liǎo)整治力度。
其次,強化制度建設,針對問題加強立法立規工作。據介紹,國(guó)家食藥監總局将加快推進《藥品檢查管理辦法》《中藥材生産質量管理規範》《藥品數據管理規範》等相關監督管理制度的(de)建設工作;針對中藥材規範化種養殖、供應鏈管理、數據可靠性等方面,進一(yī / yì /yí)步完善制度,以(yǐ)期通過加強監管制度的(de)建設,逐步解決當前存在(zài)的(de)問題,提升中藥産品質量水平。
國(guó)家食藥監總局藥品化妝品注冊司中藥民族藥處處長王海南表示,全球植物藥發展進入了(le/liǎo)新的(de)曆史階段,我國(guó)中醫藥事業也(yě)進入更高發展階段,我國(guó)藥品注冊改革、監管出(chū)現新的(de)變化,正在(zài)推行的(de)改革措施方向清晰,将從體制機制上(shàng)填補漏洞,确保人(rén)民用藥安全有效。
相關鏈接:修訂中的(de)GAP将有哪些變化
1月20日,在(zài)武漢召開的(de)“2017年中藥質量與安全風險防控論壇”上(shàng),《中藥材生産質量管理規範》(GAP)修訂進展獲進一(yī / yì /yí)步披露。
2017年10月25日,爲(wéi / wèi)進一(yī / yì /yí)步推進實施中藥材生産質量管理規範,保證中藥材質量安全和(hé / huò)穩定,國(guó)家食藥監總局辦公廳就(jiù)《中藥材生産質量管理規範(修訂稿)》(以(yǐ)下簡稱“修訂稿”)向社會公開征求意見。
據參與GAP修訂工作的(de)中國(guó)醫學科學院藥用植物研究所王秋玲博士介紹,此次GAP修訂工作充分吸取了(le/liǎo)GAP實施14年、認證13年的(de)經驗,并借鑒了(le/liǎo)世界衛生組織GACP、日本GAP、歐盟GACP、美國(guó)GAP的(de)相關内容,主要(yào / yāo)在(zài)七個(gè)方面進行了(le/liǎo)修訂:一(yī / yì /yí)是(shì)明确種質種源和(hé / huò)農藥要(yào / yāo)求;二是(shì)明确質量管理的(de)觀念和(hé / huò)要(yào / yāo)求;三是(shì)明确要(yào / yāo)求按技術規程管理基地(dì / de)建設;四是(shì)明确對關鍵生産環節進行規範管理;五是(shì)尊重中藥材生産的(de)技術和(hé / huò)管理實際水平;六是(shì)明确傳承,同時(shí)鼓勵采用新技術;七是(shì)明确環境保護和(hé / huò)動物保護要(yào / yāo)求。
對此,中國(guó)食品藥品檢定研究院中藥民族藥檢定所副所長孫磊表示,中藥材質量問題的(de)主因在(zài)藥材源頭,解決中藥材質量問題需要(yào / yāo)從源頭入手。
論壇上(shàng),國(guó)家食藥監總局藥品化妝品監管司藥品生産監管處處長崔浩介紹,GAP修訂旨在(zài)提升中藥材的(de)質量水平。此次修訂主要(yào / yāo)考慮以(yǐ)下幾點:首先,既堅持高标準、嚴要(yào / yāo)求,也(yě)兼顧實際執行,穩步推進;其次,借鑒GMP思路,在(zài)強化全過程細化、明确管理的(de)同時(shí),突出(chū)和(hé / huò)強化對中藥材質量有重大(dà)影響的(de)關鍵環節的(de)管理,比如農殘、重金屬超标問題等;同時(shí),規範生産過程,并以(yǐ)保證中藥材質量穩定、可控、可追溯爲(wéi / wèi)核心,将風險管理的(de)現代理念、意識、原則嵌入中藥材生産的(de)全過程。
據悉,修訂中的(de)GAP共有14章146條,比此前增加了(le/liǎo)4章89條,将從管、控、防、禁、建五個(gè)方面入手,努力解決影響中藥材質量的(de)問題,促進中藥材質量不(bù)斷提升。
“推行修訂後的(de)GAP,将有利于(yú)中藥材生産加工環節進一(yī / yì /yí)步規範,從源頭中藥材着手,鼓勵從種養殖、初加工到(dào)規模倉儲的(de)質量溯源管理,确保上(shàng)遊優質原料的(de)供應。”崔浩說(shuō)。













